您的购物车目前是空的!
CHO细胞DNA残留检测试剂盒
Biowing® CHO 残留 DNA 检测试剂盒用于定量检测各种生物制品的中间品、半成品和成品中 CHO 宿主细胞 DNA。
本试剂盒采用一套引物探针在FAM通道定量检测样品中 CHO 残留 DNA,另外一套引物探针在HEX通道检测内参DNA。
描述
CHO 残留 DNA 检测试剂盒(探针法) 【产品规格】 CHO 100 100 Reactions/盒 【产品说明】 Biowing® CHO 残留 DNA 检测试剂盒用于定量检测各种生物制品的中间品、半成品和成品中 CHO 宿主细胞 DNA。 本试剂盒采用一套引物探针在FAM通道定量检测样品中 CHO 残留 DNA,另外一套引物探针在HEX通道检测内参DNA。 该试剂盒具有以下特点: 灵敏:最低检测限可低至1 fg/μL。 简单:标曲定量参考品预分装并冻干,绘制标曲简单。 可靠:试剂盒配套有CHO DNA 定量参考品,已溯源至国家标准品;抽提加入内参核酸,全过程质量控制。 准确:样品加标回收,评估 DNA 提取的效率、回收率和准确度,评估验证分析方法和系统性能,进一步保证结果的准确性。 快捷:操作时间短,3 h内出结果。 【运输及保存条件】 低温冷冻运输,-20 ℃保存,有效期1年;使用后仍存放在 -20 ℃,不可反复冻融超过三次。 【产品组分】 A:B:
注:本试剂盒提供的其他试剂,使用前先低速离心后小心开启。使用时请上下轻柔颠倒十次混匀,避免起泡,并低速短暂离心后使用。 【操作步骤】 1. 产品组分的复溶 Biowing®CHO Primer&Probe Mix、内部质控(IC)、CHO DNA 定量参考品(1 pg/μL)用12000 rpm 离心2 min后,分别用242 μL/管和220 μL/管、275 μL/管RNase Free Water复溶,混匀1min后瞬离。 2. qPCR 反应液的准备 (1)根据所要检测样品的数量,计算所需反应孔数,每个样本做3复孔。 反应孔数=1个无模板对照NTC+1个阴性质控 NCS+(5个浓度梯度的标准曲线+样本数+加标回收质控 ERC)×3 (2)根据反应孔数计算所需的qPCR Mix 总量(需有1孔的加样损失量): Mix =(反应孔数+1)×20 μL (3)各试剂放室温融化,并根据下表所示准备 qPCR Mix: 表2 qPCR Mix的配制
3. 样本制备(自备) v 配制 CHO DNA 标准曲线 (1)取三条含CHO DNA 标准曲线定量参考品的8连管; (2)5000 rpm离心10min; (3)8连管的前五个孔中每个孔加入10μL RNase Free Water; (4)涡旋振荡混匀,短暂离心 5 秒; (5)浓度依次为10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL。 v 待测样品的制备 (1)取 200 μL 待测样本加入 1.5 mL 干净的离心管中,再加入 10 μL IC,标记为样品。 (2)待测样品进行样品抽提前处理,制备成样品纯化液。 v 加标回收质控 ERC 的制备 根据需要设置 ERC 中的 CHO DNA 加样浓度(以制备加 10 pg CHO DNA 量的样品 ERC 为例),具体操作如下: (1)取 200 μL 待测样品加入 1.5 mL 干净的离心管中。 (2)加入 10 μL CHO DNA 定量参考品(1 pg/μL),再加入 10 μL IC,混匀,标记为样品 ERC。样品 ERC 和同批待测样品一起进行样品抽提前处理,制备成样品 ERC 纯化液。 v 阴性质控 NCS 的制备 (1)取 200 μL RNase Free Water加入 1.5 mL 干净的离心管中,再加入 10 μL IC,标记为阴性质控 NCS。 (2)同待测样品一起进行样品抽提前处理,制备成阴性质控 NCS 纯化液。 注:样本抽提前处理具体见附录1 4. 加样 qPCR 反应体系及条件反应体系以30µL为例: (1)震荡混匀 qPCR Mix,低速离心,将管盖残留液体收集至管底。 (2)向每孔反应管/CHO DNA 标准曲线定量参考品反应管中分装 20 μL qPCR Mix。 (3)向已分装过 qPCR Mix 的反应管中加入15 μL石蜡油。 (4)向反应管中穿过石蜡油层加样,3000 rpm 瞬离5 s,加样示例如下: 表 3 加样示例
注:建议其他不同类型样本,先做适应性验证,因为不同样本性质不同。 PCR 仪设置以ABI 7500 为例,相对定量模式,选择TaqMan 探针法:
【阈值设置】 以ABI 7500 为例,扩增曲线选择 log 法,基线设置3-15个循环。建议用 log 法扩增曲线保证结果稳定可靠。 (1) 内参(HEX/VIC)阈值设定:以阴性质控 NCS定内参扩增曲线阈值,将内参的Ct 值定为 28±2。 (2) CHO(FAM)阈值设定:以标曲最高浓度定CHO扩增曲线阈值,将CHO(FAM)的Ct值定为19±2。 【结果判读】 根据CHO(FAM) Ct 值判定是否发生CHO残留,具体标准如下:
1. 检查内参通道扩增是否正常,扩增曲线是否选择log 法。 2. 内参扩增不正常,表明 PCR反应未正常进行,PCR 体系受到干扰,需重复检测。 3. 内参扩增正常,结合 Ct 值和扩增曲线形态判断。 4. 无典型扩增曲线,可认为该样本为CHO无残留。有典型扩增曲线,需重复检测,重复结果不一致判为无残留;结果一致,判为有残留。 5. 根据待测样品和样品ERC的检测结果计算加样回收率,加样回收率要求在50%~150%之间,具体算法见附录4。 6. 上机结束后,在程序的右上角点击“plate setup” 栏下的“Assign Targets and Samples/Assign target(s) to the selected wells”,选中标准品的反应格,在右侧的“Task”栏 下选择“
”,设置好每个梯度的重复孔,在“Quantity”下输入所做的浓度,依次将标准品的梯度设置完成。 7. 点击“Analysis”栏下的“Standard Curve”即可读取标准曲线的R²、扩增效率(Eff%)和斜率(Slope);正常的标曲:R²>0.99;扩增效率在 90%≤Eff%≤110%范围内;Slope 在-3.4 左右。 【注意事项】 由于 PCR 反应非常灵敏,实验操作中应注意以下事项,以免发生DNA 污染: 1. 建议分区操作和分区存放。 A区:样本DNA提取,建议在超净工作台完成; B区:配制mix和qPCR阴性加样,建议在超净工作台完成; C区:按照先加待测样本,后配制标曲的顺序加样; D区:qPCR扩增检测。 2. 建议在 qPCR 反应板上阳性对照的排布应远离待测样本和阴性对照;使用不同的移液器添加阳性对照与待测样本、阴性对照,并使用带滤芯的枪头进行加样。 3. 试剂盒开启后,试剂 Mix、阴性对照存放在B区,阳性对照应存放在C区。 4. qPCR 封膜时须反复压紧。 5. 每周用核酸清除剂清洁无菌操作台、传递窗和桌面。 6. 垃圾建议当场封闭并丢弃。 7. 对具体样品的 DNA 加标量设定在其无加标测试值的 2-10 倍为宜。 8. 本产品仅作科研用途。 【附录 1 样本抽提前处理方案】 在实验前请完整阅读本说明书,务必重视注意点! n 样品处理 样品可手工抽提,也可机器抽提。 核酸抽提注意事项 Ø 请尽量在完成样品纯化处理当天进行后续的 DNA 检测,以保证检测结果的准确性。 Ø 手抽提取纯化操作过程建议在二级生物安全实验室或安全柜中进行。 手抽样品制备期间: Ø 小心地将样品溶液加到核酸吸附柱上。枪头中的样品进入核酸吸附柱而不湿润柱的边缘。 Ø 不同液体在转移之间更换枪头。使用带滤芯的枪头。 Ø 避免用枪头接触核酸吸附膜。 【附录 2相关设备耗材】 n 实验所需但试剂盒中未含材料 Ø RNase Free Water Ø 无水乙醇(分析纯) Ø PCR 8 连管或 96 孔板,相应管盖或覆膜 Ø 1000μL,100μL,10μL 无菌低吸附滤芯枪头 Ø 1.5mL,2mL 无菌低吸附离心管 n 相关设备 Ø 迷你离心机 Ø 漩涡振荡器 Ø 金属浴 Ø 1000 μL,100 μL,10 μL 移液枪 Ø 荧光定量 PCR 仪 Ø 生物安全柜 Ø 微孔板迷你离心机 【附录 3 无菌操作规范】 无菌操作规范 1、除高速离心机外,其他设备和耗材应放在无菌操作台中,保证无菌。 2、样本高速离心后,要对离心管喷酒精,并用棉球擦拭离心管外壁,同时更换干净的板架和新手套。 3、实验前用1% 84消毒液擦净台面及四周,放好需用的实验器材及各种溶液,并用酒精棉球擦拭,更换干净的管架。 4、对着桌面,空间喷洒1% 84消毒液,然后将超净工作台通风机打开,超净工作台和紫外灯打开 30~45 分钟,再将无菌室紫外灯打开 30~45 分钟后关闭,再通风 15 分钟。关闭紫外,拉开小一半隔离,用酒精棉球擦拭超净工作台桌面2遍,关上隔离。 5、进入无菌室操作前,双手在操作台内手臂部分用75%的酒精擦拭消毒。穿专用工作服、帽及拖鞋、口罩,应放在无菌室缓冲间,工作前经紫外线消毒后使用。 6、无菌室温度宜控制在 18~28 ℃,湿度在 45%~65%(温湿度计应该用无水的)。 7、从枪头盒中取出枪头时,尖部不能触及外露部位及离心管和管架边。 8、操作尽量在酒精灯前操作。打开离心管前,酒精灯灼烧镊子,待冷却后用镊子开关管盖。 9、操作中,不能在样品上方翻转瓶盖,袖口不能掠过样品上方。 10、实验完毕,清洁台面。 11、实验者在实验后用肥皂清洗双手。 12、换下的专用实验服,进行紫外线,一次性鞋套额帽子扔进垃圾桶。 13、用毕,再开紫外灯消毒 30 分钟。 14、无菌室和缓冲间定期大扫除,保持整洁。 15、定期检查紫外灯灯管。每隔两周需用酒精棉球轻轻擦拭,除去上面灰尘和油垢,以减少紫外线穿透的影响。如灯管发黑,超过使用期限,及时更换紫外灯管。 16、每周用核酸清除剂清洁无菌操作台、传递窗和桌面。 17、垃圾建议当场封闭并丢弃。 2、注意事项 (1)工作台面上,禁止存放不必要的物品,以保证工作区域内的洁净气流不受干扰。 (2)禁止在工作台面上记录,工作时应尽量避免作明显扰乱气流的动作。(3)根据环境洁净度,每 3~6 个月将中效过滤器中的滤料拆下清洗。一般情况下,当无纺布滤料容纳尘埃较多、表面发黑时即可拆下进行清洗,或者予以更换。 (4)风机转速调至最大时,仍不能达到所需要的风速时(即风速≤0.2m/s),则必须更换高效空气过滤器。 【附录 4 核酸抽提仪日常清洁】 核酸抽提仪日常清洁 1.每周用核酸清除剂清洁一次,推荐使用近岸蛋白的Nucleic Acid Cleaner(M126-01A)。 2.每天实验结束后用1% 84消毒液喷核酸抽提仪台面和四周,然后用纸擦净。 3.每天下班前打开核酸抽提仪的门通风过夜。 4.如遇核酸抽提仪污染特别严重,可以先用清水先擦拭3遍,再用核酸清除剂和1% 84消毒液清洁,最后用纸擦净。 5.实验前,用84擦拭仪器和紫外照射约2.5个小时。 【附录 4 样品回收率】 1、标准曲线的构建 以标准品 5个浓度梯度下的平均Ct值为纵坐标,5个梯度的Log10上样量为横坐标,构建标准曲线。
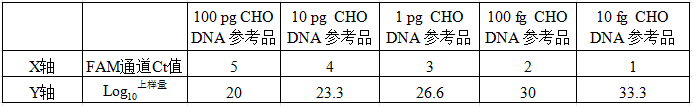
2、利用标准曲线计算样品回收率 (按照加入1 pg/µl CHO DNA 参考品计算)
注:洗脱体积按照100uL计算



.png)
评价
目前还没有评价