您的购物车目前是空的!
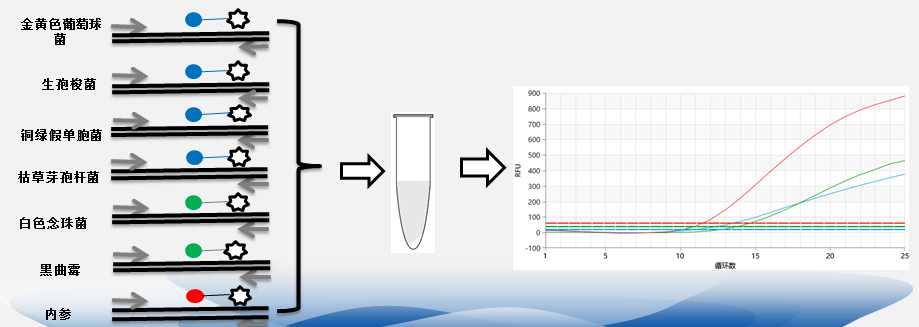
真菌细菌快检检测
基于TaqMan探针荧光定量PCR原理的检测方案:选择细菌(金黄色葡萄球菌、生孢梭菌、枯草牙孢杆菌、铜绿假胞杆菌)和真菌(白色念珠菌和黑曲霉)基因中特异基因片段,分别设计引物和荧光探针,快速检测4种细菌和2种真菌的基因组DNA。
结合相关的样本前处理和DNA抽提方案,本试剂盒可以检测各类生物制品和细胞培养物中潜在的金黄色葡萄球菌、生孢梭菌、枯草牙孢杆菌、铜绿假胞杆菌、白色念珠菌和黑曲霉污染。
描述
细菌、真菌混合快检(定量PCR法)
【产品规格】
B&F01 100 Reactions/盒
【产品说明】
基于TaqMan探针荧光定量PCR原理的检测方案:选择细菌(金黄色葡萄球菌、生孢梭菌、枯草牙孢杆菌、铜绿假胞杆菌)和真菌(白色念珠菌和黑曲霉)基因中特异基因片段,分别设计引物和荧光探针,快速检测4种细菌和2种真菌的基因组DNA。
结合相关的样本前处理和DNA抽提方案,本试剂盒可以检测各类生物制品和细胞培养物中潜在的金黄色葡萄球菌、生孢梭菌、枯草牙孢杆菌、铜绿假胞杆菌、白色念珠菌和黑曲霉污染。 灵敏:配合推荐使用的核酸抽提方案,检测灵敏度达到10CFU/mL。
可靠:抽提加入内标核酸,全过程质量控制。
稳定:全程闭管操作,无交叉污染。
快捷:单管可同时检测6种菌种,检测效率高。
准确:样本设置3重复,避免假阴、阳性的出现。
【有效期】
规定储存条件下6个月。
-20 ℃取出后,可避光存放于4 ℃继续使用1周。
【产品组分】
表1 产品组分
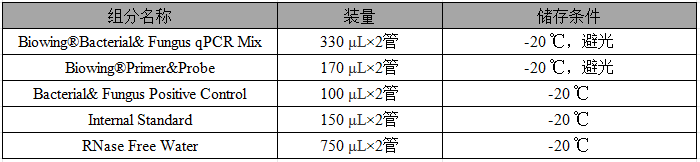
注:
1、Bacterial&Fungus Positive Control含4种细菌DNA、2种真菌DNA和内标DNA。
2、Internal Standard含有内标DNA。
在实验前请完整阅读本说明书,务必重视注意事项和无菌操作规范!
【操作步骤】
1.样本制备
(1) 样本的标准制备方案:请配合使用高效无微生物污染的DNA抽提试剂盒提取样本DNA。整个过程需要遵守无菌操作规范。本公司目前推荐抽提试剂盒见附录2。直接取20 µL待测样本DNA,作为模板进行 qPCR 反应。
(2) 前处理阴性样本准备方案:将RNase Free Water当成样本,加入内部质控(Internal standard),进行核酸抽提。
1. qPCR 反应液的准备
(1) 根据所要检测样品的数量,计算所需反应孔数,每个样本做3个重复孔。
反应孔数=1个阳性PCR质控 PC +1个阴性PCR质控+1个样本前处理阴性质控+样本数× 3
(2) 根据反应孔数计算所需的 Mix 总量(需有1孔的加样损失量):
Mix =(反应孔数+1)×10μL
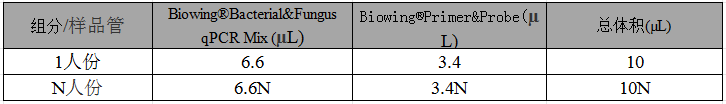
(3) 各试剂放室温融化,并根据下表所示准备 qPCR Mix:
表2 qPCR Mix的配制
2. 加样
(1)震荡混匀 qPCR Mix,低速离心,将管盖残留液体收集至管底。
(2)向每孔反应管中分装 10 μL qPCR Mix。
(3)向反应管中加入样品后短暂离心,加样示例如下:
表 3 加样示例
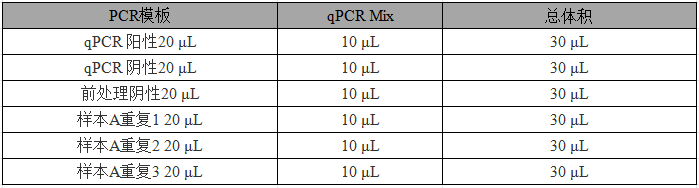
【注】:此时每个反应孔的体积为30μL
PCR 仪设置以 ABI 7500 为例,相对定量模式,选择
TaqMan 探针法:
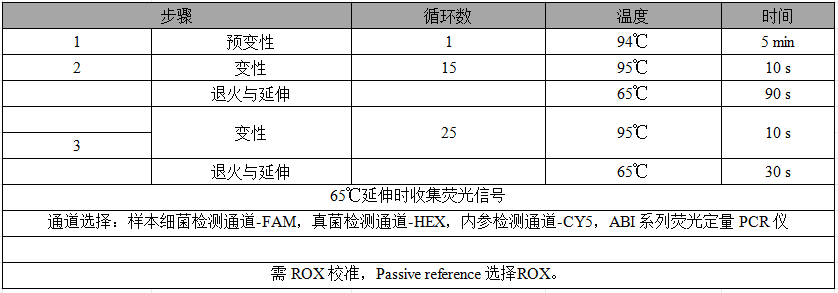
注: 1、该程序为两阶段扩增法,如荧光定量PCR仪可以两阶段收集荧光,按照正常Ct值判断结果;如果只能最后一步收集荧光,需要在原数据的基础上加15个Ct值。
2、ROX设置是以7500为例,也存在例外,例如StepOne。
【阈值设置】
以ABI 7500 为例,扩增曲线选择 log 法,基线设置1~2 个循环。建议用 log 法扩增曲线保证结果稳定可靠。
(1)内参(CY5)阈值设定:以阳性性对照定内参扩增曲线阈值,将内参的CT 值定为 29±2。
(2)细菌 (FAM)阈值设定:以阳性对照定细菌扩增曲线阈值,将细菌(FAM)的CT值定为 29±2。
(3)真菌(HEX)阈值设定:以阳性对照定细菌扩增曲线阈值,将真菌(HEX)的CT值定为 29±2。
【实验质量控制】:
如果阳性对照管的细菌(FAM)和真菌(HEX)Ct 值均>31,但阳性对照管及阴性对照管的内参(CY5)Ct 值正常,表明阳性对照模板有降解。
如果样品前处理阴性(CY5)Ct 值>32,阳性对照管的内参(CY5)Ct 值>31 ,表明内参DNA存在降解或PCR体系扩增效率下降。
【结果判读】
根据细菌(FAM) Ct 值、真菌(HEX) Ct 值、内标(CY5) Ct 值判定,具体标准如下:
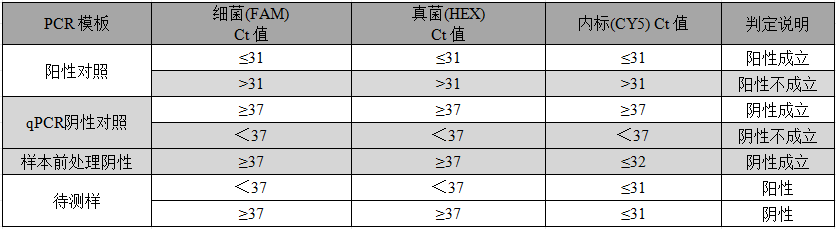
注:结果判读
1. 要求每个检测样品做3重复,如果3复孔中,两重复为阳性,则判读为阳性。
2. 建议做样本前处理阴性,可以质控整个抽提过程。
3. 如果待测样本反应中仅有FAM和CY5通道有扩增,表明存在细菌污染,若要进一步确认是何种细菌污染,推荐使用细菌检测试剂盒(货号:BD01和BD02)。
4. 如果待测样本反应中仅有HEX和CY5通道有扩增,表明存在真菌污染,若要进一步确认是何种真菌污染,推荐使用细菌检测试剂盒(货号:FD01)。
注:检测结果异常时
5. 样品前处理阴性:内参Ct值过大,表明抽提效率低;细菌和真菌检测通道Ct值小于37,可能前处理抽提过程存在污染。
6. qPCR阴性:细菌检测通道 Ct 值小于37,操作过程存在污染。
7. 样本前处理处理阴性质控 PCR阴性质控内参差±1个 Ct 值属于正常现象。
【 PCR过程注意事项】
由于 PCR 反应非常灵敏,实验操作中应注意以下事项,以免发生DNA 污染:
1、试剂盒开启后,阳性对照应与试剂 Mix、阴性对照分开存放。
2、每个组分在使用前都应先低速离心后小心开启。使用时请上下轻柔颠倒十次混匀,避免起泡,并低速短暂离心后使用。
3、要求核酸抽提和qPCR过程都符合无菌操作规范。
4、建议自备转运盒,用于将配制分装好的Mix从配置Mix超净工作台转运到加样超净工作台。
5、建议在 qPCR 反应板上阳性对照的排布应远离待测样本和阴性对照。
6、建议 qPCR 配置与分装在一个无菌操作台,样本的加样在另外一个无菌操作台。
7、建议使用不同的移液器添加阳性对照与待测样本、阴性对照,并使用带滤芯的枪头进行加样。
8、应按照先加阴性,再加样本,最后加阳性的顺序加样。且阳性用专门的加样器。建议阳性在专门的无菌操作台加样。
9、qPCR 反应板封膜或盖盖子时须反复压紧。
10、上机扩增前,反应管短时低速离心,将管壁液体收集至管底。
11、盖上反应管盖子或者贴上光学膜后,为避免影响荧光信号读取,请注意不要在管盖或者膜上做标记,或者用刮板反复摩擦。
【附录 1适用荧光定量 PCR 仪品牌型号】
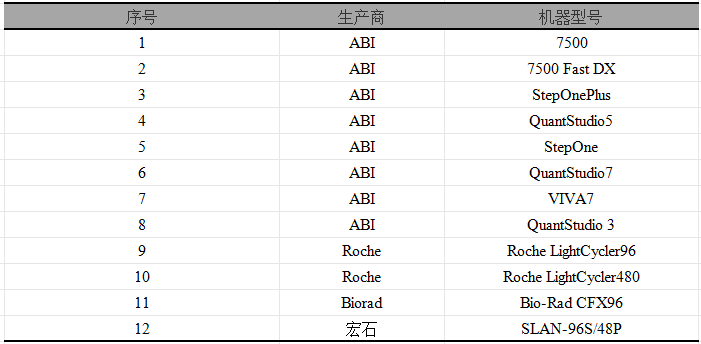
注:适用荧光定量PCR 仪为迄今为止我们客户配备的定量仪器品牌型号,如您的荧光定量 PCR 仪不在我们列出的范围,也欢迎联系我们,申请试用。
无菌操作规范
1、除高速离心机外,其他设备和耗材应放在无菌操作台中,保证无菌。
2、样本高速离心后,要对离心管喷酒精,并用棉球擦拭离心管外壁,同时更换干净的板架和新手套。
3、实验前用75%酒精擦净台面及四周,放好需用的实验器材及各种溶液,并用酒精棉球擦拭,更换干净的管架。
4、对着桌面,空间喷洒酒精,然后将超净工作台通风机打开,超净工作台和紫外灯打开 30~45 分钟,再将无菌室紫外灯打开 30~45 分钟后关闭,再通风 15 分钟。关闭紫外,拉开小一半隔离,用酒精棉球擦拭超净工作台桌面2遍,关上隔离。
5、进入无菌室操作前,双手及在操作台内手臂部分用75%的酒精擦拭消毒。穿专用工作服、帽及拖鞋、口罩,应放在无菌室缓冲间,工作前经紫外线消毒后使用。
6、无菌室温度宜控制在 18~28℃,湿度在 45%~65%(温湿度计应该用无水的)。
7、从枪头盒中取出枪头时,尖部不能触及外露部位及离心管和管架边。
8、操作尽量在酒精灯前操作。打开离心管前,酒精灯灼烧镊子,待冷却后用镊子开关管盖。
9、操作中,不能在样品上方翻转瓶盖,袖口不能掠过样品上方。
10、实验完毕,清洁台面。
11、实验者在实验后用肥皂清洗双手。
12、换下的专用实验服,进行紫外线,一次性鞋套额帽子扔进垃圾桶。
13、用毕,再开紫外灯消毒 30分钟。
14、无菌室和缓冲间定期大扫除,保持整洁。
15、定期检查紫外灯灯管。每隔两周需用酒精棉球轻轻擦拭,除去上面灰尘和油垢,以减少紫外线穿透的影响。如灯管发黑,超过使用期限,及时更换紫外灯管。
2、注意事项
(1)工作台面上,禁止存放不必要的物品,以保证工作区域内的洁净气流不受干扰。
(2)禁止在工作台面上记录,工作时应尽量避免作明显扰乱气流的动作。(3)根据环境洁净度,每 3~6 个月将中效过滤器中的滤料拆下清洗。一般情况下,当无纺布滤料容纳尘埃较多、表面发黑时即可拆下进行清洗,或者予以更换。
(4)风机转速调至最大时,仍不能达到所需要的风速时(即风速≤0.2m/s),则必须更换高效空气过滤器。



评价
目前还没有评价