您的购物车目前是空的!
小鼠端粒长度检测试剂盒
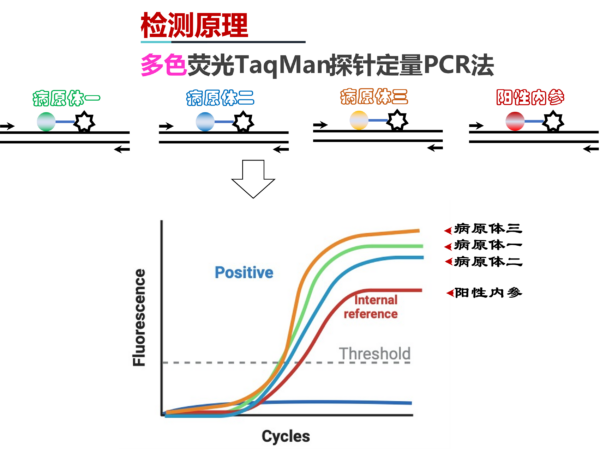
本产品试剂盒采用荧光 qPCR(SYBRgreen)检测端粒长度,检测对象为血液、组织DNA或细胞DNA。
端粒(Telomeres):是真核生物线性染色体末端的非编码串联重复性(TTAGGG)n阵列,端粒长度的变化,与衰老、癌症、或神经退行性等多种疾病相关。定量PCR法是检测端粒长度的经典技术,用时短,操作简单,结果准确,适用于批量样本检测。
描述
小鼠端粒长度检测试剂盒使用说明书(定量PCR法) 【产品规格】 1. TLM50 50*2*3 Reaction 【产品说明】 端粒(Telomeres):是真核生物线性染色体末端的非编码串联重复性(TTAGGG)n阵列,端粒长度的变化,与衰老、癌症、或神经退行性等多种疾病相关。定量PCR法是检测端粒长度的经典技术,用时短,操作简单,结果准确,适用于批量样本检测。 本产品试剂盒采用荧光 qPCR(SYBRgreen)检测端粒长度,检测对象为血液、组织DNA或细胞DNA。该试剂盒具有以下特点。 1. 稳定:全程闭管操作,无交叉污染。 2. 方便:操作简单,无需电泳步骤。 3. 相对定量:引入一个端粒长度检测的标准品,用于构建标曲得到拟合方程,可获得样品的相对长度(T/S)。 【运输及存条件】 低温冷冻运输, -20℃保存,有效期 6个月,冻融以后,4℃保存,有效期2周。 【产品组分】注:本试剂盒提供试剂,使用前请上下轻柔颠倒十次混匀,后低速离心、小心开启。避免起泡。实验时,操作须全程在冰上进行 。Biowing®Telomere Detection Mix 启用后避免反复冻融,使用结束后置于4℃保存,两周内使用完毕。Standard 1是C57幼鼠鼠尾DNA,用于构建标准曲线,端粒具体算法见附录2。 【操作步骤】 1. 样品准备及质控 端粒长度检测与样本质量相关性较大,DNA质量要求较高,如果对一批样本进行检测,若利用不同提取方式或者不同提取试剂盒提取的DNA,以及质量较差的DNA,我们建议对样本DNA进行纯化,保证样本的均一化。纯化的方式本方案采用磁珠分选的方法,具体 步骤见附录1。若采用其他纯化方式如乙醇法纯化、过柱纯化,可自行尝试;纯化后的A260/280及A260/230的比值基本相同,在1.3-2.0之间。 将样本浓度标化至10ng/µL,上样2µL。标准品的DNA浓度标化至20ng/µL,按2倍、4倍、6倍浓度梯度稀释后,上样2µL,用于构建标准曲线(其中端粒通道DNA上样量40ng 、20ng、10ng、5ng;内参通道DNA上样量为40ng 、20ng、10ng)。 2. qPCR反应液的准备 (1) 根据所要检测样品的数量,计算所需反应孔数,每个样本两个基因,分别做3 个重复孔。 端粒反应孔数=(Standard1 × 4 个梯度)× 3 +( 样本数)× 3 内参反应孔数=(Standard1 × 3 个梯度)× 3 +( 样本数)× 3 (2) 根据反应孔数计算所需的 Mix 总量(含有 1孔的加样损失量): Mix(端粒或内参) =(反应孔数+1)× 18μl (3) 各试剂放 2-8℃条件下融化,并根据下表所示准备 qPCR Mix:
3. 加样 (1)震荡混匀 qPCR Mix,低速离心,将管盖残留液体收集至管底。 (2)向每孔反应管中分装 18μL qPCR Mix。 (3)向已分装过 qPCR Mix 的反应管中加入10ul石蜡油。 (4)向反应管中加入样品后短暂离心,加样示例如下:
注:盖上八联管盖或者光学膜后盖上反应管盖子或者贴上光学膜,为避免影响荧光信号读取,请注意不要在管盖或者膜上做标记,或者用刮板反复摩擦。反应管短时低速离心,将管壁液体收集至管底;充分震荡混匀后,再短时低速离心,将管盖和管壁的残留液体收集至底,如有气泡,需将气泡排尽。 PCR仪设置以 宏石SLAN 96S 为例,其他型号定量PCR仪应通过标准品进行参数校正或咨询专业技术人员。
【阈值设置】 1. 以宏石SLAN-96S为例,扩增曲线算法选择绝对荧光值法,基线设置在2-7个循环 2. 阈值设定:以标准品CT值设置内参和端粒扩增曲线阈值,将内参的CT值定为 25±1,将端粒的CT值定为 9-12 。阈值的设定要保证样本及标准品的3重复的△CT在0.3以内。 3. 阈值设置以后,如下图所示,标准曲线个的浓度梯度之间呈现较好的CT差异,端粒通道和内参通道的△CT均在 1 左右。
说明: (1)根据标准品标准曲线 , 若最后一个浓度梯度的CT值过大,表明试剂盒扩增效率下降或仪器运行障碍。 (2)调整阈值线后,标准品的几个浓度梯度之间的△CT相差过大,说明操作有误。 备注: 端粒长度计算方法见附录2 附录 1 磁珠法纯化DNA参考步骤 使用英莱盾 LD102-060 DNA 片段筛选功能磁珠试剂盒,在纯化DNA的同时可以去除不良样本中因降解产生的小片段DNA。磁珠上样量已经经过摸索在保证得率的情况下,最大程度的去除小片段。 准备工作: 将磁珠由 2-8℃中取出,室温平衡至少 30min,配制 80%乙醇。 Step1 涡旋震荡或充分颠倒磁珠以保证混匀。 Step2 结合(吸附目的片段) 1. 取样本DNA(建议DNA总量>500ng,体积>20μL),向样本DNA中加入0.6倍样本DNA体积的磁珠,使用移液器小心吹打 10 次; 2. 室温静置 5min; 3. 室温 12000rpm 离心 30s(该步骤可以加速聚集磁珠,可选); 4. 将离心管置于磁力架上至溶液完全澄清(约 1min),弃去上清。 Step3 清洗 保持离心管固定于磁力架上,加入 80%乙醇(加入的体积视情况而定,若在1.5ml离心管中纯化加入200μL,在200μL离心管中纯化加入100μL),静置 1min,无需重悬磁珠,弃去上清(保持离心管固定于磁力架上);重复该操作一次。 Step4 除醇 保持离心管置于磁力架上,静置通风 2-5min 除醇。 注:除醇过程中请勿过分干燥磁珠,否则会降低纯化效率。 Step5 洗脱 1. 将离心管从磁力架上取下,加入 30μL 洗脱液(建议使用TE,水洗脱可能会降低纯化效率)洗脱,使用移液器小心吹打 10 次; 2. 室温静置 5min; 3. 室温 12000rpm 离心 30s(该步骤可以加速聚集磁珠,可选); 4. 将离心管置于磁力架上至溶液完全澄清(约 1min),待磁珠完全吸附后将上清转移至新样品管中备用。 附录 2 结果与计算 1. 标准曲线的构建 以标准品3个或4个浓度梯度下的平均CT值为横坐标,log2浓度为纵坐标,构建标准曲线
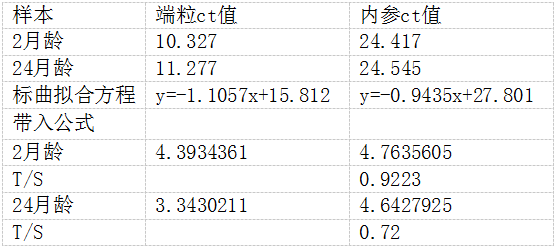
2. 利用标准曲线计算样本的T/S 将样本的端粒和内参通道的CT值代入标准曲线方程,即可得到样本的T/S 下图为两个小鼠组织样本(2月龄、24月龄)的计算示例


评价
目前还没有评价